董敏组JACS:揭示土壤细菌产含砷抗生素的酶机制
2024-08-10

胂丝菌素(arsinothricin,AST)是由土壤细菌产生的一种具有广谱抗菌活性的含砷抗生素。胂丝菌素生物合成的关键步骤C-As键构筑被预测是由ArsL蛋白催化。ArsL具有保守的CxxxCxxC结构域,被归类为SAM自由基酶,然而ArsL的反应活性和机制未知。近日,物质绿色创造与制造海河实验室科研骨干、天津大学董敏教授课题组以实验室为完成单位在美国化学会志JACS在线发表了题为“Arsinothricin Biosynthesis Involving a Radical SAM Enzyme for Noncanonical SAM Cleavage and C-As Bond Formation”的研究论文。本研究发现ArsL催化非经典的SAM切割反应,通过产生ACP自由基,与底物亚砷酸反应产生AST-OH,进而在甲基转移酶ArsM作用下最终产生胂丝菌素。还发现ArsL C端结构域RCCLKC对底物识别有重要作用。ArsL蛋白是迄今发现的首个具有经典的SAM自由基酶CxxxCxxC结构域,但不产生5´-脱氧腺苷自由基,而通过切割SAM产生ACP自由基的SAM自由基酶。该发现预示SAM自由基酶家族可能有更多类似酶存在。
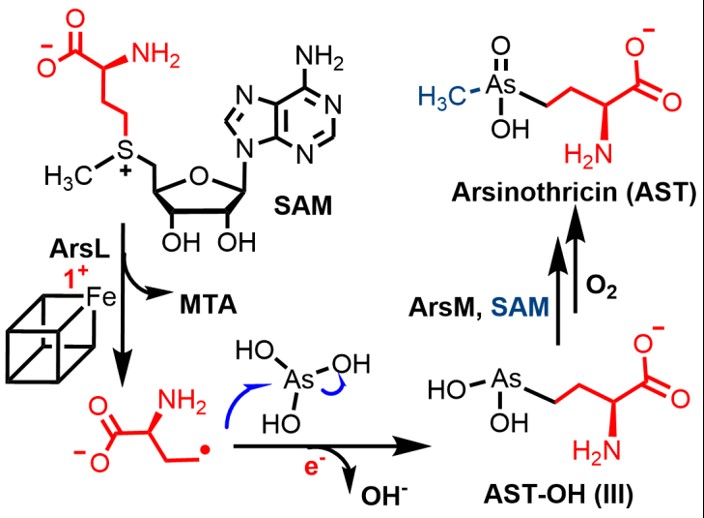
图1胂丝菌素可能的生物合成途径。
砷是广泛分布于自然界的有毒准金属元素,主要以无机砷的形式存在。细菌可将无机砷转化为有机化合物由此降低毒性,如甲基砷酸等。胂丝菌素是在土壤细菌Burkholderia gladioliGSRB05代谢物中发现的一种含砷有机物,其结构与谷氨酸类似,因此可作为谷氨酰胺合成酶抑制剂,具有抗菌抗病毒活性。其生物合成涉及两个蛋白ArsL和ArsM。推测ArsL催化第一步反应,切割辅因子SAM产生ACP,并与底物亚砷酸反应催化C-As键的形成,产生AST-OH;甲基转移酶ArsM催化第二步反应,负责AST-OH甲基化形成AST,如图2。
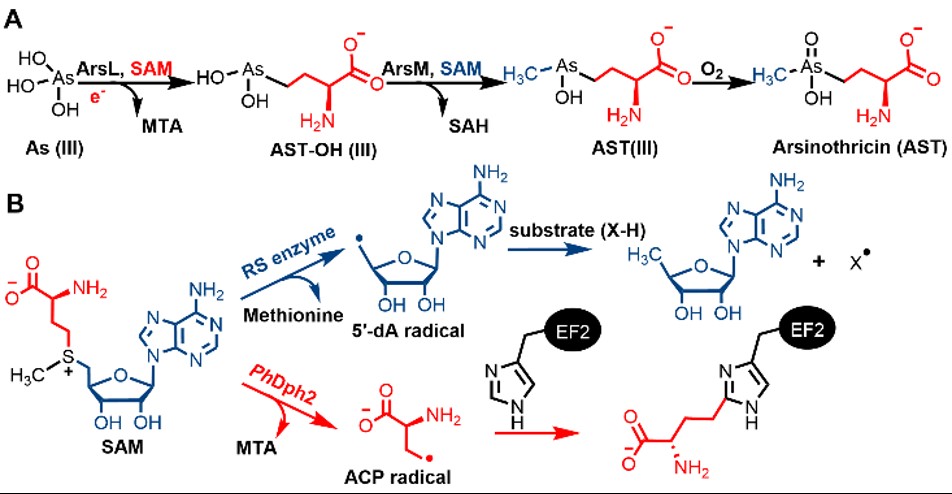
图2(A) 推测胂丝菌素生物合成途径。(B)经典SAM自由基酶和非经典SAM自由基酶Dph2催化的SAM切割反应
ArsL含有保守的CxxxCxxC结构域,因此被预测为SAM自由基酶家族成员。SAM自由基酶通过CxxxCxxC结构域与[4Fe-4S]簇结合。还原的[4Fe-4S]+簇切割SAM生成5´-脱氧腺苷(5´-dA)自由基,进而攫取底物氢原子产生底物自由基催化下游反应。目前只有白喉酰胺生物合成中的非典型SAM自由基酶(不含保守CxxxCxxC结构域)Dph2通过自由基机制切割SAM产生ACP自由基,修饰底物蛋白EF2(图2)。此外,许多酶通过亲核机制裂解SAM催化ACP转移反应。
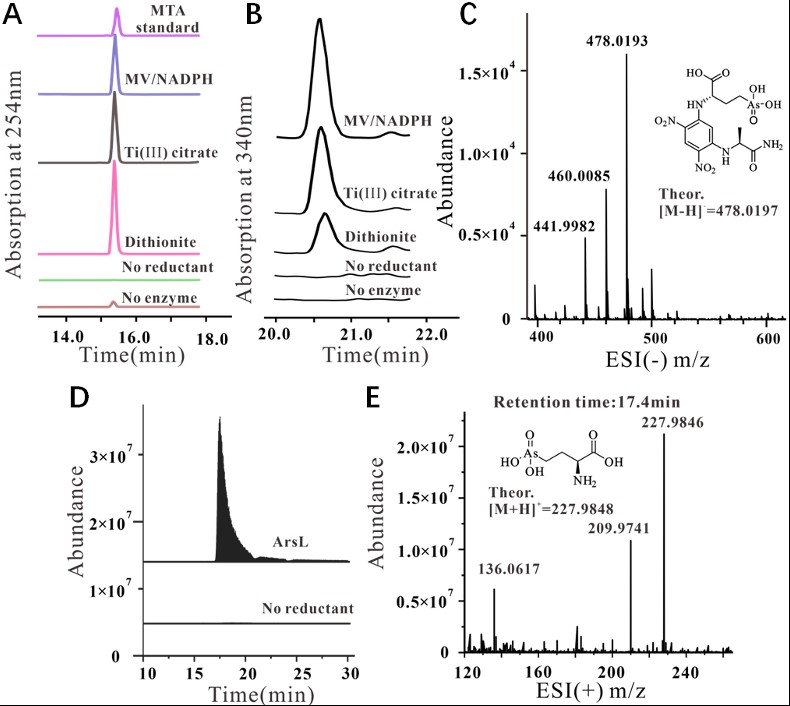
本文作者通过一系列体外实验证实ArsL蛋白能通过自由基机制催化非经典SAM切割反应。ArsL蛋白在还原剂连二亚硫酸钠(DT)参与下能切割SAM的 Cγ,Met-S键产生MTA。在HPLC-HRMS直接检测及衍生化反应条件下均检测到L-高半胱氨酸亚磺酸(DT淬灭ACP自由基产物)。(图3,4)在柠檬酸钛(III)作为还原剂时检测到2-氨基丁酸产生。证明ArsL蛋白能催化非经典SAM切割反应。
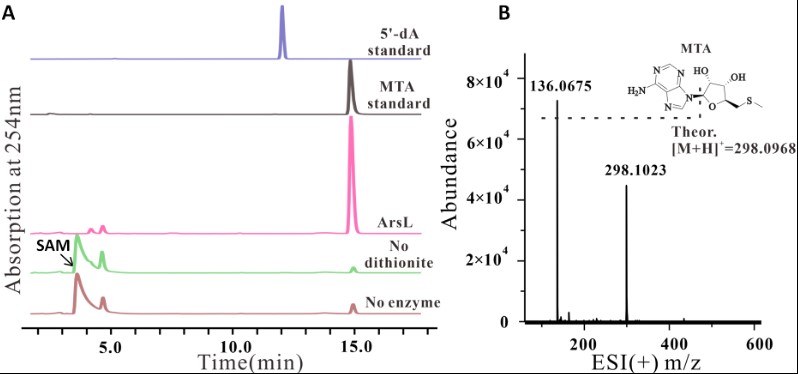
图3 ArsL的SAM裂解反应。(A)还原的ArsL切割SAM产生MTA。(B)总反应中分离的MTA质谱。
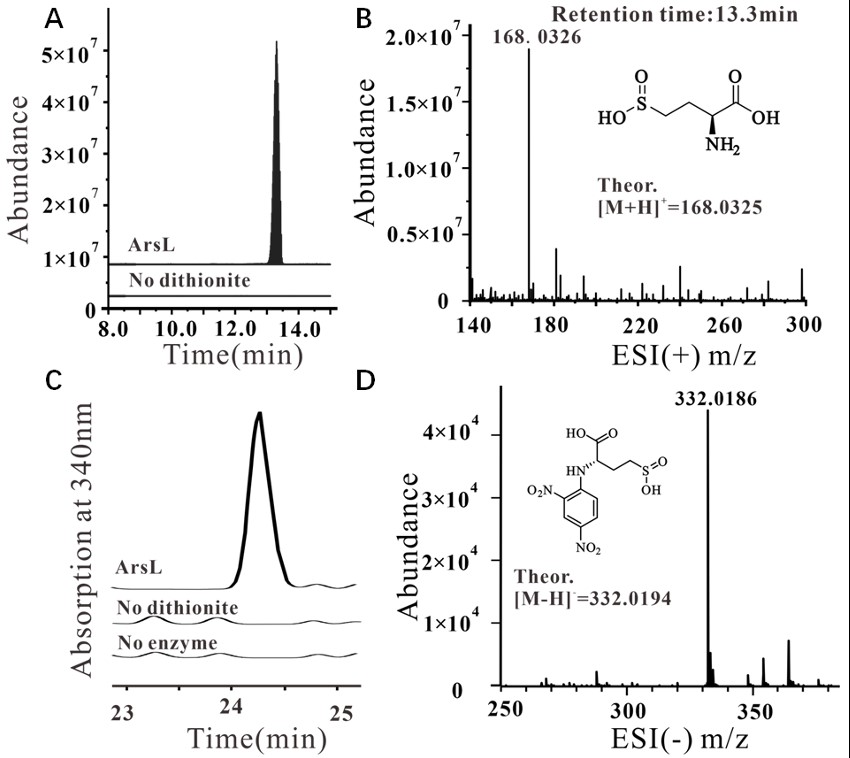
图4 DT淬灭的ACP自由基产物HSA的检测。(A)LC-MS检测反应中HSA。(B)HSA质谱数据(13.3 min)。(C)HPLC检测反应DNFB衍生化。(D)HSA衍生化质谱。
在底物亚砷酸存在的反应中,不同还原剂催化的反应有显著差异。其中,DT作为还原剂时,虽然切割SAM产生MTA量最多,但是衍生化反应发现产物AST-OH量最低。这是因为DT与底物结构相似,和底物之间存在竞争关系。MV/NADPH以及柠檬酸钛做还原剂都有大量产物AST-OH产生。(图5)在ArsL与ArsM的串联反应中检测到了终产物AST(图6)。
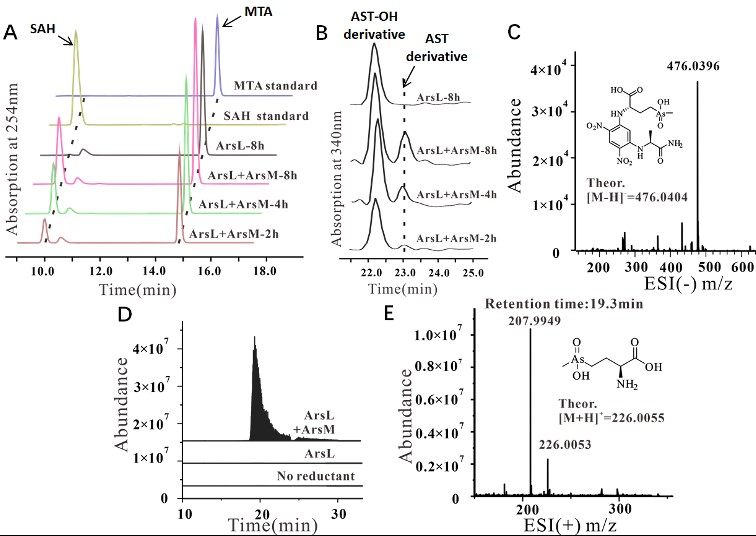
为进一步研究该类酶的特性,我们进行blast序列分析,发现ArsL C端保守序列RCCLKC,通过序列截短和半胱氨酸突变证明了此段序列对底物识别的重要性。NCBI数据库中含有RCCLKC-tail SAM自由基酶家族(NCBI HMM accession NF040542.1),我们推测该家族成员均能催化非经典SAM切割反应。
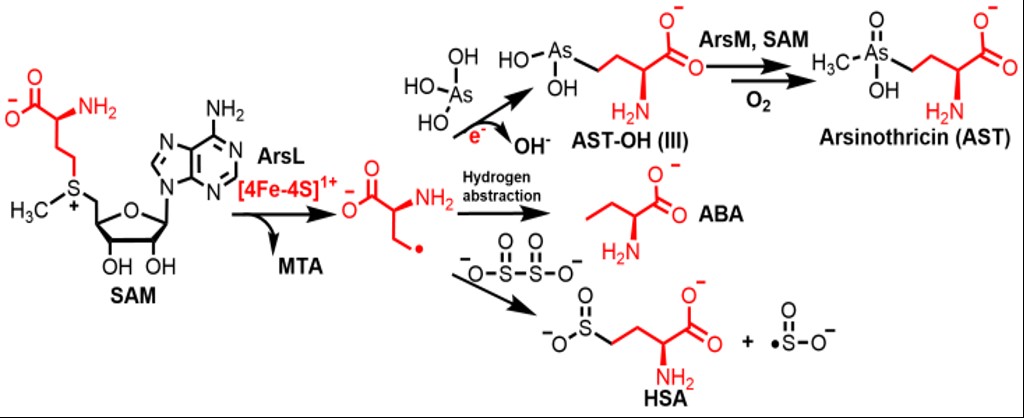
图7 推测的ArsL反应机制
综上,实验证明了SAM自由基酶ArsL能催化非经典SAM切割反应产生ACP自由基,并通过ArsM串联,体外重构了AST生物合成。(图7)ArsL蛋白是目前发现唯一的含有保守基序CxxxCxxC,并通过自由基机制催化非经典SAM切割反应的SAM自由基酶,预示着该家族可能有更多类似酶通过产生ACP自由基催化反应。
天津大学硕士研究生姚亚娣和何家乐为论文的共同第一作者,物质绿色创造与制造海河实验室科研骨干、天津大学董敏教授为论文的通讯作者。
来源:研之成理





